МУКОВИСЦИДОЗ
(Современные достижения и актуальные проблемы)
Авторы – сотрудники Российского Центра Муковисцидоза:
Капранов Н.И., Каширская Н.Ю., Шерман В.Д., Воронкова А.Ю.,
Шабалова Л.А., Никонова В.С., Кусова З.А., Пухальский А.Л., Шмарина Г.В.
Под редакцией Капранова Н.И. и Каширской Н.Ю
Настоящие методические рекомендации предназначены для педиатров, врачей общего профиля и других специалистов в области здравоохранения, осуществляющих диагностику и терапию муковисцидоза. При их составлении основное внимание уделялось доступным в любой стране методам лечения. Методы терапии, требующие самых современных технологий и больших финансовых затрат, а также средства лечения, не прошедшие стадии экспериментальных исследований, изложены предельно кратко.
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ДЛЯ ВРАЧЕЙ ПО МУКОВИСЦИДОЗУ - 2011
Отрывок из книги: раздел ГЕНЕТИКА
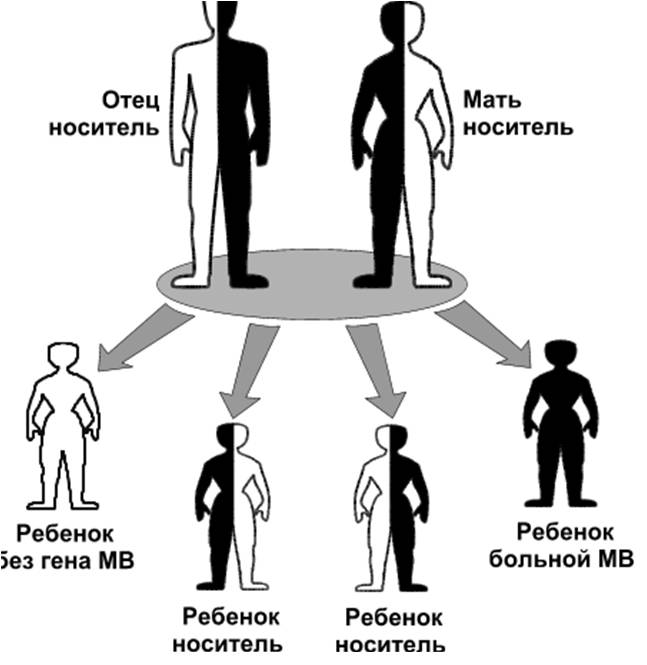 Муковисцидоз наследуется по аутосомно-рецессивному типу. Так как оба родителя гетерозиготны по аномальному гену МВТР и, следовательно, являются лишь его носителями, вероятность рождения ребенка с МВ равна 25% (Рис.1). При каждой последующей беременности этот показатель риска остается неизменным: «риск не имеет памяти».
Муковисцидоз наследуется по аутосомно-рецессивному типу. Так как оба родителя гетерозиготны по аномальному гену МВТР и, следовательно, являются лишь его носителями, вероятность рождения ребенка с МВ равна 25% (Рис.1). При каждой последующей беременности этот показатель риска остается неизменным: «риск не имеет памяти».муковисцидоз наследование Клинические проявления МВ развиваются только у гомозигот по аномальному гену МВТР, у его носителей обычно не выявляется типичных симптомов заболевания.
Ген МВТР был изолирован в 1989г. Он содержит 27 экзонов, охватывает 250000 пар нуклеотидов и расположен в середине длинного плеча 7 хромосомы. На сегодняшний день выделено более 1200 мутаций гена, ответственных за развитие симптомов МВ. Проведенные в 1999-2000гг мультицентровые исследования с участием отечественных ученых (Н.И.Капранов, Е.К.Гинтер, В.С.Баранов) охватили 17 стран Центральной и Восточной Европы, включая Россию. В результате этих исследований предложен список из 33 частых мутаций, характерных для этих стран. Среди них наиболее частой является мутация DF508, второй по частоте- CFTR dele 2,3 (21kb). Частота 6 мутаций (N1303K, G542Х, W1282Х, 3849+10kbC®T, 2143delT, 2184insA) более 1%. Обнаружено около 75% всех МВ аллелей больных МВ России (табл.2).
Таблица 2. Относительные частоты мутаций в гене МВТР у больных муковисцидозом в России (Н.В.Петрова, 2004)
| Мутация | Число мутаций\Число хромосом |
Относительная частота (%) |
Экзон\Интрон (э\и) |
| E85Q | 0/42* | - | Э3 |
| 394delTT | 6/416* | 0,7 | Э3 |
| R117H | 0/57* | - | Э4 |
| L138ins | 1/259* | 0,2 | Э4 |
| 604insA | 1/259* | 0,2 | Э4 |
| 621+1G-T | 1/259* | 0,2 | И4 |
| R334W | 5/378* | 0,7 | Э7 |
| R347P | 0/378* | - | Э7 |
| I507del | 0/488* | - | Э10 |
| F508del | 526/1014 | 51,9 | Э10 |
| 1677delTA | 6/488* | 0,6 | Э10 |
| G542X | 16/415* | 1,9 | Э11 |
| G551D | 1/415* | 0,1 | Э11 |
| R553X | 1/415* | 0,1 | Э11 |
| 1717-1G-A | 0/57* | - | И11 |
| 2143delT | 16/376* | 2,0 | Э13 |
| 2184insA | 14/376* | 1,8 | Э13 |
| S1196X | 4/372* | 0,5 | Э19 |
| 3667delTCAA | 1/372* | 0,1 | Э19 |
| 382delT | 3/48* | 3,0 | Э19 |
| 3849+10kbC-T | 7/231* | 1,5 | И19 |
| W1282X | 20/362* | 2,7 | Э20 |
| 3944delTG | 1/350* | 0,1 | Э20 |
| N1303K | 20/404* | 2,4 | Э21 |
| CFTRdele2,3(21kb) | 54/424* | 6,1 | И1-Э3 |
| неидентифицированные | 24,0 |
* - число обследованных МВ хромосом без мутации F508del
Прогресс в изучении генетики муковисцидоза важен не только в перспективе генной терапии, но и возможности первичной его профилактики (предупреждения рождения больного МВ). Эффективная дородовая ДНК-диагностика МВ осуществляется в Москве, Санкт-Петербурге, Уфе, Томске. Кроме того ДНК-обследование помогает в дифференциальной диагностике сложных форм МВ. Научные исследования преследуют цель изучения корреляции генотип\фенотип. В ряде работ было показано, что наиболее тяжелая и ранняя манифестация наблюдается у больных гомозигот по DF508 (частота которой в среднем по России составляет 53%, а в Москве - 41%). Больные, гомозиготные по отсутствию DF508, - отличаются наибольшим клиническим полиморфизмом, т.е. наряду с тяжелыми формами, ранней манифестацией и ранним неблагоприятным исходом, наблюдаются относительно благоприятные формы болезни, диагностируемые в старшем детском и подростковом возрастах.
Мутации гена МВТР в гомозиготном состоянии приводят к нарушению синтеза белка, формирующего хлорный канал в мембранах эпителиальных клеток, через который происходит пассивный транспорт ионов хлора. Этот белок называют муковисцидозым трансмембранным регулятором проводимости.
Мутации гена МВТР следует подразделять на классы в зависимости от типа и тяжести первичного повреждающего эффекта (табл. 3-4). Это следует учитывать при разработке новейших терапевтических технологий, направленных на “остановку” патофизиологического процесса при МВ на ранней стадии: ингаляционные аминогликозиды применяются при мутациях I класса, фенилбутират и циклопентинксантин – II класса, генестин – III класса и др. Подробнее об этих новых подходах к патогенетической коррекции основного дефекта при МВ будет сказано ниже.
Таблица 3. Классы мутаций в гене CFTR. Подразделение на классы отражает известные или предполагаемые биосинтетические и функциональные последствия (по Kerem B. S., Kerem E., 1996; Tsui L. C.,1992; Welsh M. J., Smith A. E., 1993; Witt H., 2003; Rowntree R. K., Harris A., 2003; Mishra A. et al., 2005].
| Класс I | Класс II | Класс III |
Класс IV |
Класс V |
Класс VI |
| Нарушение синтеза протеина | Нарушение процессинга или транспорта | Нарушение регуляции | Снижение проводимости | Снижение уровня нормальных молекул белка или РНК | Снижение стабильности протеина |
|
G542X W1282X R553X 621+1C-T 2143delT 1677delTA |
F508del N1303K I507del S549I S549R
|
G551D G1244E S1255P
|
R334W R347P R117H
|
3849+10kbC-T A455E IVS8(5T) 1811+1,6kbA-G
|
Q1412X 4326delTC 4279insA 4271delC S1455X
|
Таблица 4. Классификация мутаций МВТР по тяжести фенотипического проявления (Kerem, 1996)
| "тяжелые" | "мягкие" | "варьирующие" |
|
DF508 G542X G551D R553X W1282X N1303K 1677delTA 621+1G-T 1717-1G-A CFTRdele2,3(21kb) |
R117H 3849+10kbC-T R347P T338I G551S
|
G85E R334W 5T
|
Несмотря на интенсивные исследования взаимосвязи между генотипом и фенотипом при МВ, вероятно, вследствие многообразия мутаций в гене CFTR четкая ассоциация между генотипом и другими клиническим проявлениями (бронхолегочными поражениями, поражениями печени) не была выявлена.
Отсутствие прямой взаимосвязи между мутациями в МВТР гене и другими клиническими проявлениями заболевания предполагает, что совокупность иных факторов (отличных от МВТР гена) может влиять на клиническую картину заболевания [Петрова Н.В. , 2009; Тимковская Е.Е., Петрова Н.В., Каширская Н.Ю. и др., 2008].
В настоящее время годы ведутся интенсивные поиски кандидатных генов модифицирующих характер и степень поражения ряда жизненно важных органов и, прежде всего, брохолегочной системы. Наибольший интерес представляют: маннозосвязывающий лектин (MBL), фактор некроза опухолей (TNF-a), класс II гистосовместимости (HLA-class II), синтаза оксида азота I типа (nitric oxid synthase type I), β-дефензины (β-defensins), трансформирующий фактор роста β1 (TGF β1), сурфактант-ассоциированные белки А и Д (surfactant-associated proteins A and D), α1-антитрипсин (АТ-α1). Считают, что за патологию желудочно-кишечного тракта отвечают модулирующий локус хромосомы 19q13 (СFM1) (мекониальный илеус), Ca2+-активированный канал проводимости калия (KCNN4), маннозо-связывающий лектин (MBL), АТ-α1. Ряд авторов полагает, что риск развития поражения печени у больных МВ может зависеть от наличия: аллеля DQw6 генов главного комплекса гистосовместимости, маннозо-связывающего лектина (MBL2), мутаций Z и S гена ингибитора протеаз (А1АТ) и др. В исследовании Петровой Н.В. было показано, что полиморфизмы и мутации генов eNOS, MBL2 и HFE1 ассоциированы с тяжестью патологического процесса при МВ как со стороны бронхолегочной системы, так и системы пищеварения, по крайней мере, у российских больных, гомозиготных по мутации F508del, а в гене HFE-1 и с более высокой выживаемостью [Петрова Н.В., 2009; Тимковская Е.Е., Петрова Н.В., Каширская Н.Ю. и др., 2008].
Прогресс в изучении генетики МВ важен не только в перспективе генной терапии, но и возможности первичной его профилактики (предупреждения рождения больного МВ).





