http://atm press.ru
Введение
Благодаря ранней диагностике и новейшим терапевтическим режимам заболевание давно перестало быть чисто педиатрической проблемой [1, 2].
Муковисцидоз обусловлен мутациями в гене CFTR (CFTR – cystic fibrosis transmembrane conductance regulator – муковисцидозный трансмембранный регулятор проводимости). Белок CFTR, функционируя как цАМФФзависимый хлорный канал, регулирует работу других хлорных и натриевых каналов, участвует в проведении воды, аденозинтрифосфата и выполняет ряд других важных функций [3]. В результате генетического дефекта секрет большинства желез внешней секреции сгущается, затрудняется его эвакуация, в органах возникают вторичные изменения.
В настоящий момент описано около 2000 мутаций и более 200 полиморфизмов в гене CFTR, частота которых широко варьирует в разных этнических группах. Установлена четкая зависимость между недостаточностью внешнесекреторной функции поджелудочной железы и мутациями в гене CFTR. Однако связь между другими проявлениями МВ и генотипом CFTR неоднозначна. В частности, течение бронхолегочного процесса, в 90% случаев определяющее качество и продолжительность жизни больных МВ, не зависит напрямую от генотипа CFTR.
Pseudomonas aeruginosa справедливо считается наиболее значимым у больных МВ респираторным возбудителем, который обнаруживается приблизительно у 27% пациентов в возрасте 2–5 лет и у 80% пациентов в возрасте 25–34 лет [4]. Инфекции дыхательных путей, вызванные P. aeruginosa, тяжело поддаются лечению вследствие роста патогенного микроорганизма в виде биопленочных макроколоний (мукоидный штамм) и сопровождаются прогрессирующим снижением легочной функции, повышением риска госпитализаций и уменьшением выживаемости больных.
Чтобы избежать развития лекарственной устойчивости и попытаться ликвидировать немукоидные штаммы P. aeruginosa, лечение антибиотиками начинают сразу же после первого выявления этого патогенного микроорганизма. У больных МВ, изначально пораженных мукоидными штаммами P. aeruginosa, или у пациентов, у которых немукоидные штаммы уже превратились в мукоидные, невозможно достичь их полной эрадикации [5]. Этим обусловлено разделение курсов антибактериальной терапии на три вида: терапия первого высева – для предотвращения хронической колонизации P. aeruginosa; базисная (постоянная) терапия для увеличения интервала между обострениями и замедления прогрессирования поражения легких при хронической инфекции; терапия собственно обострения бронхолегочного процесса [2, 6].
В последние 20 лет во всем мире с большим успехом применяются ингаляционные антибиотики, которые позволили заменить традиционные курсы парентеральной антибактериальной терапии при первом высеве P. aeruginosa, а также стали основными в базисной терапии хронической инфекции. Ингаляционный путь введения позволяет создать высокие концентрации препарата непосредственно в очаге инфекции и благодаря этому преодолеть резистентность микроорганизмов при низком риске системных побочных эффектов. К сожалению, сегодня немногие антибиотики могут применяться ингаляционно. Растворы для парентерального использования не подходят для ингаляций, так как имеют высокую осмолярность, кислотность и содержат консерванты, в частности фенолы, что вызывает раздражение дыхательных путей (кашель, хрипы, боли в грудной клетке). Недавно появились антибиотики в виде сухой пудры для ингаляций, что дало возможность доставлять в дыхательные пути больше лекарства за более короткие сроки. В настоящее время специальные ингаляционные формы (растворы и порошки для ингаляций) существуют для колистиметата натрия, тобрамицина и азтреонамализина (АЗЛИ); проходят последние клинические испытания ингаляционные формы левофлоксацина, ципрофлоксацина, амикацина и фосфомицина [4, 7–9].
Ингаляционные антибиотики
Аминогликозид тобрамицин – это антибактериальный препарат, который ингибирует синтез белка, необратимо связываясь с субчастицей 30S бактериальной рибосомы. Он эффективен против большинства грамотрицательных палочек, но обычно не проявляет значимого действия против штаммов Burkholderia cepacia complex и S. maltophilia, хотя воздействует на штаммы Enterococcus и Staphylococcus.
Проникновение через стенку бактериальной клетки является энергозависимым процессом и ухудшается в анаэробных условиях, поэтому низкое парциальное давление кислорода в гнойных пробках при МВ может ограничивать эффективность тобрамицина [10]. В растворе тобрамицина для ингаляций (РТИ) тобрамицин заряжен положительно, и считается, что при МВ он связывается в дыхательных путях с отрицательно заряженными нитями ДНК и альгинатом P. aeruginosa. Тем не менее прерывистое (28 через 28 дней) лечение с использованием 300 мг тобрамицина 2 раза в день значимо улучшало у больных МВ функцию легких и уменьшало плотность обсеменения мокроты P. aeruginosa в сравнении с показателями при использовании плацебо [4, 11–13]. В двух открытых неконтролируемых исследованиях при аэрозольном применении тобрамицина у большинствапациентов с МВ в сроки до 3 мес была достигнута эрадикация P. aeruginosa, что сопровождалось уменьшением нейтрофильного воспаления в дыхательных путях [5].
В целом РТИ переносится хорошо. В клинических исследованиях не наблюдалось токсичности в отношении почек или выпадения волос, хотя слабый или умеренный преходящий шум в ушах чаще возникал у пациентов, получавших РТИ, чем в группе плацебо. Бронхоконстрикция после ингаляции РТИ отмечалась при применении как РТИ без консервантов, так и растворов тобрамицина, содержащих консерванты, в частности фенол [14]. Использование ингаляционных β-адреномиметиков может предотвратить снижение функции легких после ингаляции [14].
Применение ингаляционного тобрамицина у больных МВ оправданно с точки зрения медицины, основанной на доказательствах (уровень А), и рекомендовано национальными и международными рекомендациями по лечению легочной инфекции, вызванной P. aeruginosa. Регулярная терапия ингаляционным тобрамицином курсами по 4 нед с 44недельными перерывами рекомендуется больным МВ, у которых имеются среднетяжелое или тяжелое поражение легких и хроническая инфекция дыхательных путей, вызванная P. aeruginosa. Результаты рандомизированных контролируемых исследований показали, что у таких пациентов регулярные ингаляции тобрамицина способствуют увеличению объема форсированного выдоха за 1-ю секунду (ОФВ1) и массы тела, снижению частоты госпитализаций, парентерального применения других антисинегнойных антибиотиков и временной нетрудоспособности, а также улучшению качества жизни. В ретроспективном анализе данных большой группы больных МВ, включенных в американский Регистр пациентов Фонда муковисцидоза, было выявлено, что ингаляционная терапия тобрамицином приводит также к снижению смертности больных, это служит дополнительным доводом в пользу более строгого выполнения современных рекомендаций по лечению МВ [15].
Европейским консенсусом по ингаляционной терапии рекомендованы к применению два препарата РТИ – Тоби (Novartis Pharmaceuticals) и Брамитоб (Chiesi Farmaceutici) [16]. Эти препараты не отличаются друг от друга по содержанию действующего вещества, способу ингаляции и схеме назначения. В прямом сравнительном исследовании было установлено, что они не уступают друг другу по клинической эффективности и улучшению микробиологических показателей [41]. Однако имеющиеся различия в свойствах этих растворов (концентрация, осмолярность) определяют их различия в скорости ингаляции (время ингаляции Брамитоба короче на 30%) и переносимости терапии (в многоцентровом рандомизированном контролируемом исследовании число пациентов, выбывших по причине возникновения нежелательных эффектов со стороны органов дыхания (кашель, бронхоспазм), было меньше при использовании Брамитоба). В России накоплен большой опыт применения как Тоби, так и Брамитоба.
В последние годы была разработана и зарегистрирована форма тобрамицина в виде порошка (ТП) (сухой пудры) для ингаляций. Частицы, содержащие действующее вещество (ПульмоСферы), упакованы в капсулы и распыляются из активируемого дыханием портативного порошкового ингалятора ТТ326 (Novartis Pharmaceuticals).
Каждая капсула с ТП содержит 28 мг активного вещества [18]. Время, необходимое для ингаляции одной дозы ТП, составляет 6 мин, что на 14 мин меньше, чем для ингаляции Тоби [19].
Порошковый тобрамицин и РТИ имеют сходную фармакокинетику, что было доказано в многоцентровом рандомизированном открытом когортном исследовании I фазы.
Фармакокинетика небулизированного РТИ в дозе 300 мг в мокроте более точно соответствовала фармакокинетике ТП в дозе 112 мг [20].
В настоящее время опыт применения ТП ограничен, но специалисты полагают, что такие факторы, как простота использования, сокращение времени на лечение и минимальный уход за ингалятором, увеличат приверженность больных к лечению и теоретически могут повысить его эффективность у некоторых категорий пациентов [19].
Несомненно, что появление новой формы тобрамицина позволит в целом улучшить качество антибактериальной терапии, но также очевидно, что она не может быть альтернативой РТИ в полной мере. Несмотря на удобство новой формы тобрамицина, в клинических исследованиях частота связанных с использованием препарата нежелательных явлений, особенно со стороны органов дыхания, превышала 50%. Так, например, частота возникновения кашля в группе пациентов, получавших ТП, была более чем в 5 раз выше, чем в группе РТИ [21, 22]. Известно также, что многие пациенты не смогут в полной мере воспользоваться преимуществами порошкового ингалятора из-за невозможности обеспечить эффективный инспираторный поток (более 30 л/мин) [23].
Хотя колистиметат натрия для ингаляций применяется у больных МВ для лечения инфекций, вызванных P. aeruginosa, более 20 лет, контролируемых исследований на эту тему мало. При наблюдении 40 больных МВ было выявлено, что ингаляции колистиметата натрия способствуют уменьшению симптоматики и профилактируют снижение функции внешнего дыхания [24]. При сравнении колистиметата натрия с РТИ последний более эффективно улучшал функцию легких, хотя все препараты уменьшали плотность обсемененности мокроты P. aeruginosa [25, 26]. В сочетании с пероральным приемом ципрофлоксацина ингаляции колистиметата натрия обеспечивали эффективную эрадикацию P. aeruginosa на 24 мес более чем у 80% получавших лечение больных МВ [27].
Пациенты с МВ в целом хорошо переносят колистиметат натрия, однако нередко наблюдается бронхоконстрикция, особенно у лиц с бронхиальной астмой или гиперреактивностью дыхательных путей [28, 29]. Необходимо проводить ингаляцию колистиметата натрия сразу после его разведения, поскольку по прошествии длительного времени препарат гидролизуется с образованием оснований колистина А (полимиксин Е1) и колистина Б (полимиксин Е2).
Колистиметат натрия нельзя применять для лечения больных МВ из-за тяжелых нежелательных явлений [30].
Следует отметить, что в 2011 г. было закончено рандомизированное двойное слепое исследование III фазы по безопасности новой формы колистиметата натрия в виде пудры, применяемой через ингалятор (Colobreathe, Forest Laboratories, Великобритания), и после регистрации препарата Европейским медицинским агентством в 2012 г. Он начал применяться в Европе [9].
Азтреонама лизин
Азтреонам – это синтетический антибиотик монобактамного ряда (моноциклический β-лактам), который активен в отношении грамположительных аэробных микроорганизмов и устойчив к действию большинства β-лактамаз.
В двойном слепом плацебоконтролируемом исследовании Iб фазы больные МВ в возрасте >12 лет в стабильном состоянии самостоятельно вводили 1 раз в сутки AЗЛИ с повышением дозы с 75 до 150 и 225 мг либо плацебо; было выявлено сохранение антисинегнойной активности антибиотика при введении с помощью небулайзера и отсутствие ингибирования его активности мокротой [33].
Азтреонама лизин проявлял активность в отношении мультирезистентной P. aeruginosa и при умеренной концентрации в мокроте был активен в отношении штаммов Burkholderia cepacia complex с геномоварами с I по V. Препарат хорошо переносился. Наиболее частым нежелательным явлением было усиление кашля, особенно при высокой дозе АЗЛИ. Легкие или умеренно выраженные побочные эффекты проявлялись стеснением в груди и заложенностью носа. Концентрация АЗЛИ в мокроте превышала МИК50 по крайней мере в течение 4 ч после введения [33].
В другом двойном слепом рандомизированном плацебоконтролируемом исследовании III фазы изучали применение АЗЛИ в дозе 75 мг при введении 3 раза в день в сравнении с плацебо [34]. У больных, получавших препарат, выявлено значимое улучшение клинических симптомов, увеличение ОФВ1 и снижение плотности P. aeruginosa в колониеобразующих единицах через 28 дней. Процент не желательных явлений был аналогичным. В 18-месячном исследовании получено подтверждение безопасности и эффективности препарата у пациентов детского возраста [35].
В настоящее время проводится 66месячное исследование III фазы, в котором сравнивают АЗЛИ в дозе 75 мг 3 раза в день и РТИ 2 раза в день по схеме 28 через 28 дней.
Разрабатываемые антибиотики
В открытом продолжительном исследовании, в котором изучалось применение препарата Arikace в дозе 560 мг/сут повторными курсами по 28 дней с перерывами в 56 дней, был доказан его выраженный клинический эффект в виде улучшения легочной функции и снижения бактериальной обсемененности, которые сохранялись даже в безынгаляционном периоде [9]. В настоящее время идет набор пациентов для участия в 6-месячном международном исследовании III фазы, в котором будет сравниваться клиническая эффективность и безопасность липосомального амикации на Arikace и РТИ (Тоби) у взрослых пациентов с хронической синегнойной инфекцией.
Ципрофлоксацин – фторхинолон, воздействующий на функцию гираз у бактерий, широко используется в пероральной форме у пациентов с МВ и другими заболеваниями. Введение ципрофлоксацина в виде аэрозоля (ранее известного как BAY Q3939), с мелкими частицами или заключенного в липосомы, морским свинкам, инфицированным Legionella pneumophilia, или мышам, инфицированным Francisella tularensis, предотвращало смерть животных, что свидетельствует о доставке аэрозоля в нижние отделы дыхательных путей [36, 37]. При использовании через соответствующие небулайзеры разрушение липосом было минимальным. После успешного завершения исследований I и II фазы по изучению безопасности и эффективности ингаляционного применения липосомального ципрофлоксацина была подтверждена возможность назначения препарата 1 раз в день [9, 38].
Лекарственная форма фторхинолона левофлоксацина для аэрозольного введения, ранее называемая MPP376, была зарегистрирована под названием Aeroquin (Mpex Pharmaceuticals, США) и специально подготовлена для введения через небулайзер eFlow. Aeroquin в настоящее время проходит клиническую оценку (III фаза) у больных МВ, после того как результаты у здоровых добровольцев продемонстрировали его хорошую переносимость [39]. Длительность ингаляции не превышает 4–6 мин [9]. Основным путем элиминации препарата из легких является системное всасывание.
Комбинация препарата фосфомицина и тобрамицина в соотношении 4 : 1 специально разработана компанией Gilead Sciences (США) для использования с помощью небулайзера eFlow для борьбы с P. aeruginosa [9].
Применение ингаляционных антибиотиков в России
Нами проведены успешные клинические исследования и накоплен опыт длительного применения препаратов РТИ, зарегистрированных под маркой Тоби (300 мг/5 мл, Novartis Pharmaceuticals) и Брамитоб (300 мг/4 мл, Chiesi Farmaceutici). Прерывистое (28 через 28 дней) лечение с использованием обеих форм ингаляционного тобрамицина по 300 мг 2 раза в день значительно улучшает функцию легких и уменьшает плотность обсеменения мокроты P. aeruginosa у больных МВ. Идентичная эффективность обоих препаратов ингаляционного тобрамицина была установлена в рандомизированных контролируемых клинических исследованиях. В прямом сравнительном исследовании ингаляции Брамитоба и Тоби в течение 4 нед вызывали сопоставимое увеличение ОФВ1, которое сохранялось в течение 4 нед после прекращения терапии [41]. Кроме того, у пациентов, продолжавших получать Брамитоб прерывистыми курсами, достигнутые показатели сохранялись на протяжении всего периода наблюдения – 48 нед дополнительно [17]. Брамитоб в отличие от Тоби содержит 300 мг тобрамицина в 4 мл 0,45% раствора хлорида натрия, что позволяет сократить длительность ингаляции и способствует улучшению приверженности к лечению [42]. А соответствие осмолярности раствора Брамитоба таковой на поверхности бронхиального эпителия при МВ снижает частоту возникновения бронхоспазма после ингаляции препарата [43].
В 2012 г. в России была зарегистрирована новая форма тобрамицина с порошковым ингалятором – Тоби Подхалер (ТП в капсулах по 28 мг), который назначается по 112 мг 2 раза в сутки [22]. Российские специалисты принимали участие в одном из нескольких международных исследований, в которых фармакокинетику, распределение в легких, переносимость, безопасность и клиническую эффективность новой порошкообразной лекарственной формы тобрамицина сравнивали с таковыми традиционного небулизированного РТИ или плацебо у больных МВ [18]. Было выявлено, что порошкообразная лекарственная форма тобрамицина лучше депонируется в легких, чем сопоставимая доза небулизированного тобрамицина, и позволяет более эффективно и быстро доставить лечебную дозу препарата в легкие при сходных системных фармакокинетических характеристиках. Новая форма подтвердила эффективность и безопасность, сопоставимые с таковыми для небулизированной формы. Применение Тоби Подхалера занимает гораздо меньше времени (5,6 мин по сравнению с 19,7 мин для небулизированного Тоби и с 12,1 мин для Брамитоба при использовании небулайзера Pari LC Plus), и почти полностью отсутствует необходимость в обработке ингалятора, таким образом, он может стать более удобным для больных старшего возраста и способствовать улучшению их приверженности к лечению. Следует отметить, что в работе M. Govoni et al. было показано, что при использовании ингалятора Pari eFlow Rapid время ингаляции раствора Брамитоба может быть значительно снижено, до сопоставимого с таковым для Тоби Подхалера – 5,7 ± 2,0 мин [44].
Отсутствие широкого опыта применения, а также наличие ряда существенных ограничений в использовании ТП у значительной группы пациентов не позволяют полностью заменить РТИ на ТП.
Категории больных, которым по-прежнему рекомендуется назначение РТИ, – дети в возрасте до 8 лет (иногда и старше), которые не могут обеспечить инспираторный поток, необходимый для эффективного использования порошкового ингалятора (более 30 л/мин); пациенты с тяжелым течением заболевания с выраженной обструкцией; пациенты, ослабленные после хирургических вмешательств, в связи с наличием осложнений МВ или сопутствующих заболеваний.
Лечение инфекции Pseudomonas aeruginosa
Как уже указывалось выше, антибиотикотерапия у больных МВ при высевании P. aeruginosa из бронхиального секрета проводится в следующих случаях:
1) при обострении бронхолегочного процесса;
2) профилактически у больных без признаков обострения бронхолегочного процесса:
• при первых высевах из мокроты P. аeruginosa с целью предупреждения развития хронической синегнойной инфекции;
• больным с хронической синегнойной инфекцией с целью предупреждения прогрессирования бронхолегочного процесса.
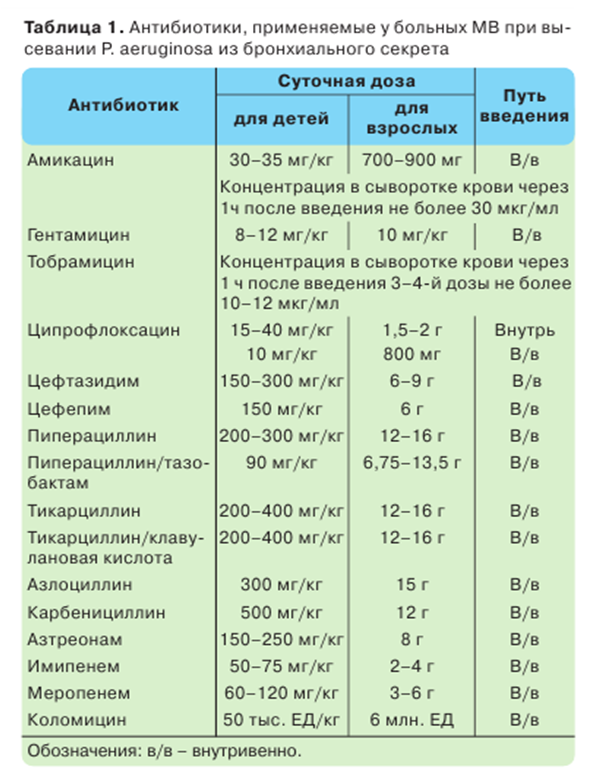
Терапия обострения бронхолегочного процесса при хронической инфекции P. aeruginosa
Большинство антибиотиков, применяемых для лечения синегнойной инфекции в период обострения бронхолегочного процесса, вводятся парентерально, как правило внутривенно. Терапия обычно проводится двумя антимикробными препаратами в расчете на лучший клинический эффект в результате их синергизма и для уменьшения риска развития антибиотикорезистентности. Аминогликозиды применяются в комбинации с цефалоспоринами III–IV поколения, например, амикацин + цефтазидим или тобрамицин + цефтазидим либо цефсулодин. Другие комбинации выбираются на основании результатов антибиотикограммы и под контролем клинического ответа на лечение, например, тобрамицин + пиперациллин, амикацин + тиенамицин либо цефтазидим + азтреонам. Комбинация двух β-лактамных антибиотиков (пиперациллин, цефтазидим, цефепим, азтреонам, имипенем, меропенем и др.) не рекомендуется. Применение высоких доз антибиотиков связано с трудностью достижения их терапевтических концентраций в мокроте, особенностями фармакокинетики антибиотиков при МВ, а также со способностью мукоидных форм P. aeruginosa образовывать пленку альгината, защищающую их от действия антибиотиков. Длительность лечения составляет 14 дней и более. Критерием прекращения антибиотикотерапии является возврат основных клинических симптомов обострения бронхолегочного процесса (масса тела больного, показатели функции внешнего дыхания, характер и количество отделяемой мокроты и т.д.) к исходному для данного больного уровню [21, 45].
Обсуждается вопрос о сочетании внутривенных антибиотиков с ингаляционными аминогликозидами (тобрамицином), включая исследования российских специалистов, но достоверных данных, поддерживающих такой режим применения, пока нет, поэтому он не может быть рекомендован [46, 47].
Профилактическая терапия первого высева P. aeruginosa
Профилактические курсы антибиотикотерапии при первых высевах синегнойной палочки из бронхиального секрета снижают частоту перехода непостоянного носительства P. aeruginosa в хроническую синегнойную инфекцию с 58 до 14%, а частота санации мокроты от P. aeruginosa составляет при этом 80% [2].
В наcтоящее время существуют несколько схем ведения пациентов при первом высеве P. aeruginosa: с применением ингаляционных тобрамицинов или с использованием колистиметата натрия (колистина) в сочетании с пероральным ципрофлоксацином.
Режим дозирования РТИ (Тоби и Брамитоба) при первичном высеве синегнойной палочки – 300 мг 2 раза в день в течение 28 дней независимо от возраста пациента [40, 48]. Тоби Подхалер назначают детям старше 8–10 лет и взрослым в дозировке по 112 мг 2 раза в день также в течение 28 дней [46].
Эффективность лечения оценивают по результатам повторного микробиологического исследования.
При эрадикации возбудителя дополнительное лечение не проводится.
Если несмотря на 4-недельный курс лечения в мокроте повторно выделена P. aeruginosa, больному назначают антибактериальные препараты внутривенно (например, цефтазидим) в сочетании с амикацином или тобрамицином. Эффективность лечения оценивают по результатам повторного микробиологического исследования через 14 дней.
При выборе колистиметата натрия можно использовать рекомендации, изложенные в табл. 2. Проведенные за рубежом и в нашей стране исследования по клинической эффективности и безопасности колистиметата натрия свидетельствуют о том, что при первичном высеве синегнойной палочки он может применяться у больных МВ во всех возрастных группах непрерывным 3-недельным курсом в комбинации с пероральным ципрофлоксацином [2, 40, 46].
При невозможности применения перорального ципрофлоксацина рекомендуется провести 2-недельный курс внутривенной терапии (цефтазидим и тобрамицин) с последующим 3-месячным курсом ингаляционного колистиметата натрия [46].
Профилактическая терапия хронической бронхолегочной инфекции P. aeruginosa
При хронической синегнойной инфекции все пациенты должны получать ингаляционные тобрамицины или колистиметат натрия, причем в данном случае эти препараты назначаются уже не с профилактической, а с лечебной целью [46].

 Режим дозирования ингаляционных тобрамицинов (Тоби и Брамитоба) – 300 мг 2 раза в день в течение 28 через 28 дней вне зависимости от возраста. Тоби Подхалер назначают детям старше 8–10 лет и взрослым в дозировке по 112 мг 2 раза в день, также курсами по 28 дней.
Режим дозирования ингаляционных тобрамицинов (Тоби и Брамитоба) – 300 мг 2 раза в день в течение 28 через 28 дней вне зависимости от возраста. Тоби Подхалер назначают детям старше 8–10 лет и взрослым в дозировке по 112 мг 2 раза в день, также курсами по 28 дней.
Колистиметат натрия назначают ежедневно непрерывным курсом в виде ингаляций по 2 млн. 2–3 раза в день независимо от возраста.
Обсуждается вопрос о чередовании 4-недельных курсов колистиметата натрия и тобрамицина – попеременные курсы по 4 через 4 нед, так как в исследованиях in vitro комбинированная терапия тобрамицином и колистиметатом натрия оказывала большее воздействие на P. aeruginosa в биопленках, но этот режим еще нуждается в подтверждении эффективности и безопасности [49].
Несмотря на постоянное применение ингаляционных антибиотиков, в ряде центров МВ, в том числе в нашем, при тяжелом течении бронхолегочного процесса продолжают назначать профилактические курсы (не менее 14 дней) внутривенной антибактериальной терапии (каждые 3 мес). Наиболее часто при хронической синегнойной инфекции применяют комбинации цефалоспоринов III–IV поколения (цефтазидим, цефепим) с аминогликозидами (гентамицин, тобрамицин, амикацин), фторхинолоны и карбапенемы [2, 46].
Заключение
Таким образом, многочисленные исследования и наш собственный опыт доказали, что применение ингаляционных антибиотиков у больных МВ с первым высевом или уже с хронической инфекцией P. aeruginosa способствует стабилизации легочной функции, снижает риск госпитализаций, потребность в парентеральной антибактериальной терапии и, следовательно, общую стоимость лечения, уменьшает риск развития побочных эффектов, повышает качество жизни больных МВ. Однако эффективность ингаляционного препарата определяется не только его фармакокинетическими особенностями, но и многими другими факторами, влияющими на распределение препарата в дыхательных путях (тип небулайзера и компрессора, размер продуцируемых частиц, скорость доставки аэрозоля, возраст пациента, тяжесть поражения легких). Эти же факторы во многом определяют и приверженность (комплаентность) пациентов к лечению тем или иным лекарственным средством.
Список литературы
1. Капранов Н.И., Каширская Н.Ю. // Лечебное дело. 2010. № 2.C. 12.
2. Муковисцидоз. Современные достижения и актуальные проблемы: Метод. рек. / Под ред. Н.И. Капранова, Н.Ю. Каширской. 44е изд., перераб. и доп. М., 2011.
3. Riordan J.R. et al. // Science. 1989. V. 245. № 4922. P. 1066.
4. Каширская Н.Ю. и др. // Врач. 2010. № 3. С. 10.
5. Gibson R.L. et al. // Pediatr. Pulmonol. 2007. V. 42. P. 610.
6. Амелина Е.Л., Чучалин А.Г. // Пульмонология. 2009. № 5. С. 120.
7. Hofmann T. // Curr. Pharm. Des. 2012. V. 18. № 5. P. 683.
8. Чикина С.Ю. // Лечебное дело. 2011. № 4. С. 105.
9. Ballman M. et al. // Respir. Med. 2011. V. 105. Suppl. 2. P. S2.
10. Worlitzsch D. et al. // J. Clin. Invest. 2002. V. 109. P. 317.
11. Ramsey B.W. et al. // N. Engl. J. Med. 1993. V. 328. P. 1740.
12. Капранов Н.И. и др. // Пульмонология. 2008. № 3. С. 20.
13. Lenoir G. et al. // Paediatr. Drugs. 2007. V. 9. Suppl. 1. P. 11.
14. Ho B.L. et al. // Chest. 2002. V. 122. P. 930.
15. Sawicki G.S. et al. // Pediatr. Pulmonol. 2012. V. 47. № 1. P. 44.
16. Heijerman H.G. et al. // J. Cyst. Fibros. V. 8. № 5. P. 295.
17. Mazurek H. et al. // J. Cyst. Fibros. 2012. V. 11. P. S74.
18. Parkins M.D. et al. // Expert. Rev. Respir. Med. 2011. V. 5. № 5.P. 609.
19. Geller D.E. et al. // J. Aerosol Med. Pulm. Drug Deliv. 2011. V. 24.№ 4. P. 175.
20. Geller D.E. et al. // Pediatr. Pulmonol. 2007. V. 42. № 4. P. 307.
21. Konstan M.W. et al. // J. Cyst. Fibros. 2011. V. 10. № 1. P. 54.
22. Konstan M.W. et al. // Pediatr. Pulmonol. 2011. V. 46. № 3. P. 230.






